BLOQUE II: LAS PROPIEDADES DE LOS MATERIALES Y SU CLASIFICACION
QUIMICA.
Tema 6: Enlace químico.
ACTIVIDAD 1: EL ENLACE
QUIMICO.
APUNTE:
El enlace químico es la unión entre átomos para formar
moléculas. En la formación de enlaces, un átomo puede ganar, perder o compartir
electrones, lo cual depende del elemento del que se trate y de aquel al que se una. El enlace químico
cumple la regla del octeto de Lewis (completar ocho electrones). Los enlaces
químicos son consecuencia de las fuerzas eléctricas entre las cargas de signo
contrario, es decir, cationes y aniones.
CUESTIONARIO:
1.
¿Qué es el enlace químico?
2.
¿Qué regla se cumple en el enlace químico?
3.
¿Qué tipo de fuerza es la que permite el
enlace químico?
4.
¿Qué tipo de carga eléctrica pueden tener las
partículas?
5.
¿Cómo se llama la partícula que pierde electrones?
6.
¿Cómo se llama la partícula que gana
electrones?
ACTIVIDAD 2: ENLACE
IONICO.
LEE EL TEXTO.
|
ENLACE IONICO
En
general, los átomos de los elementos metálicos pierden sus electrones de
valencia más fácilmente que los de los no metales. Por ejemplo, cuando un
átomo de sodio, interactúa con un átomo de cloro, el electrón de valencia del
sodio es atraído con gran fuerza por los protones en el núcleo del cloro.
Bajo condiciones adecuadas, el átomo del metal puede perder este electrón, el
cual se transfiere al átomo de cloro. Cuando esto sucede, el átomo de sodio
se transforma en un ión con carga positiva Na+, pues ahora tiene
11 protones y sólo 10 electrones, y el átomo de cloro se transforma, a su
vez, en un ión con carga negativa Cl-, pues ahora tiene 17
protones y 18 electrones.
Cuando
una pieza de sodio metálico se pone en contacto con una muestra de cloro, se
produce una reacción química en la que cada átomo de sodio que interactúa con
un átomo de cloro pierde su electrón de valencia. En este proceso se forman
millones de iones sodio positivos y iones cloruro negativos. Como cargas de
signos opuestos se atraen, los iones Na+ y Cl- se
atraen unos a otros formando un
conglomerado de iones (red iónica) en el que cada ión está rodeado por iones
del signo opuesto. Este nuevo compuesto químico es el cloruro de sodio, la
sal de mesa.
La
fuerza electrostática que mantiene a los iones unidos en el cloruro de sodio
se denomina enlace iónico y se dice que esta sustancia es un compuesto
iónico. En general, cada vez que un elemento metálico reacciona con un
elemento no metálico, los átomos del metal pierden sus electrones de valencia
y forman iones positivos (llamados cationes), mientras que los átomos del no
metal ganan electrones y forman iones negativos (llamados aniones). El
resultado es un compuesto iónico.
La
mayoría de los compuestos iónicos son sustancias sólidas con altos puntos de
fusión y ebullición. Esto se debe a que la fuerza de atracción entre los
iones positivos y negativos es muy grande y
hay que invertir mucha energía para separarlos. Muchos compuestos
iónicos son solubles en agua; la disolución que se forma puede conducir
electricidad, debido a la presencia de cationes y aniones, los cuales se
mueven con facilidad cuando se aplica una fuerza eléctrica.
|
Completa
los enunciados:
1.
Cada vez que un elemento reacciona con un elemento no metálico, los
átomos del metal pierden sus electrones de valencia y forman iones positivos
(llamados cationes).
2.
Los
átomos del ganan electrones y forman
iones negativos (llamados aniones).
3.
La unión de un metal con un no metal da como
resultado un compuesto .
4.
Los compuestos iónicos se acomodan formando
un conglomerado de iones llamado iónica.
5.
La mayoría de los compuestos iónicos son
sustancias con temperaturas altas de
fusión y ebullición.
6.
Muchos compuestos iónicos son en agua.
7.
Las disoluciones de los compuestos iónicos pueden
electricidad, debido a la presencia de
cationes y aniones.
EJERCICIO:
El yoduro de potasio
es un compuesto iónico. Identifica:
1. Quién
es el metal.
2. Quién
es el no metal.
3. El
catión
4. El
anión
5. Cuantos
electrones pierde el catión
6. Cuantos
electrones gana el anión
7. Escribe
la fórmula química del yoduro de potasio.
8. Escribe
la fórmula química de cada ión.
9. Dibuja
la red iónica del yoduro de potasio.
APUNTE:
Los compuestos
iónicos son conocidos como sales, se escribe primero el símbolo del metal y
después el símbolo del no metal; pero se nombran mencionando primero al no
metal con la terminación uro y luego el nombre del metal.
Nombre del
compuesto iónico: raiz(no metal)uro de metal
NaCl cloruro
de sodio
EJERCICIO: Completa la
tabla.
|
Formula
|
Nombre
|
Metal
|
Electrones
que pierde
|
No
metal
|
Electrones
que gana
|
Modelo
de Lewis
|
Modelo
cinético corpuscular.
|
|
KCl
|
Cloruro
de potasio
|
|
|
|
|
|
|
|
LiH
|
Hidruro
de litio
|
|
|
|
|
|
|
|
CaF2
|
Fluoruro
de calcio
|
|
|
|
|
|
|
|
Cs2S
|
Sulfuro
de cesio
|
|
|
|
|
|
|
|
Rb3As
|
Arseniuro
de rubidio
|
|
|
|
|
|
|
|
CaS
|
Sulfuro
de calcio
|
|
|
|
|
|
|
|
NaBr
|
Bromuro
de sodio
|
|
|
|
|
|
|
|
GaN
|
Nitruro
de galio
|
|
|
|
|
|
|
|
Mg3N2
|
Nitruro
de magnesio
|
|
|
|
|
|
|
|
Na3P
|
Fosfuro
de sodio
|
|
|
|
|
|
|
ACTIVIDAD 3: ENLACE
COVALENTE.
LEE EL TEXTO.
ENLACE COVALENTE
Cuando
dos elementos no metálicos reaccionan químicamente ninguno de los dos átomos
pierde o gana electrones pues los electrones de valencia sienten una fuerte
atracción hacia su núcleo atómico. Sin embargo, cuando dos átomos se acercan,
el electrón de un será atraído por el protón del otro y viceversa. Esto hace
que los átomos se acerquen más y se mantengan juntos atraídos hacia los
electrones que ahora comparten. La fuerza que los une se denomina enlace
covalente.
Por
ejemplo, considera la interacción
entre un átomo de hidrógeno y uno de cloro. En este caso el único electrón de
valencia del hidrógeno será atraído por los protones en el núcleo del átomo
de cloro y uno de los siete electrones de valencia del cloro será atraído por
el protón en el núcleo de hidrógeno. Estos dos átomos se mantendrán unidos
por estas interacciones electrostáticas que involucran dos de sus electrones.
Cuando
los átomos de elementos no metálicos se combinan de esta manera se forman
moléculas y no redes iónicas. Las moléculas son grupos de dos o más átomos
que existen como partículas independientes; los átomos en una molécula están
unidos por enlaces covalentes, pero las moléculas no están unidas entre sí.
Este tipo de compuestos se denominan compuestos covalentes moleculares.
Los
compuestos covalentes moleculares pueden ser sólidos, líquidos o gaseosos a
temperatura ambiente. Por ejemplo el azúcar es un sólido, el agua es un
líquido y el dióxido de carbono es un gas.
La
formación de enlaces covalentes también puede ocurrir entre átomos de
elementos del mismo tipo. Son ejemplos
el hidrógeno natural que está constituido por moléculas con dos átomos de
hidrógeno cada una (H2), lo mismo sucede con el oxígeno (O2),
el flúor (F2) y el cloro (Cl2), entre otros. Otros
elementos como el carbono C, pueden formar múltiples enlaces covalentes entre
sus átomos; cuando esto sucede se pueden formar redes covalentes de átomos.
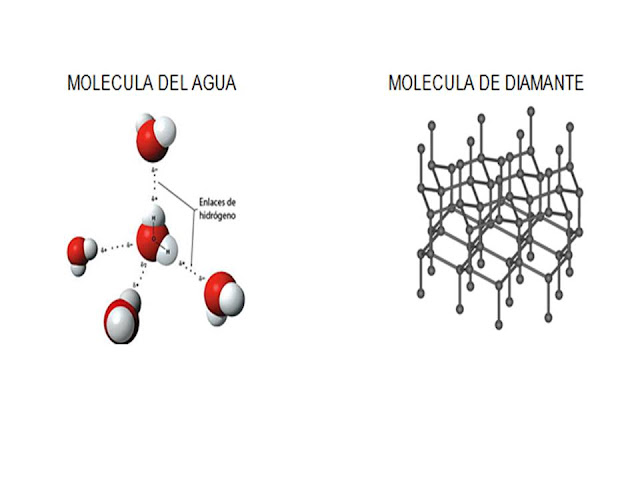
Las
sustancias constituidas por redes covalentes de átomos tienden a ser sólidos
muy duros, son insolubles en agua y no conducen la electricidad. El diamante,
una red covalente de átomos de carbono, y el silicio natural, una red de
átomos de este elemento, son ejemplos típicos.
MOLECULA DEL AGUA MOLECULA DE DIAMANTE
|
Completa
los enunciados:
1.
Cuando dos elementos reaccionan químicamente ninguno de los dos átomos pierde o
gana electrones.
2.
Cuando dos átomos de elementos no metálicos
se acercan, el electrón de un será por
el protón del otro y viceversa.
3.
Esto hace que los átomos se acerquen más y se
mantengan juntos atraídos hacia los electrones que ahora .
4.
La fuerza que une a los elementos no
metálicos se denomina enlace .
5.
Cuando los átomos de elementos no metálicos
se combinan de esta manera se forman y
no redes iónicas.
6.
Las moléculas son grupos de dos o más átomos
que existen como partículas .
7.
Los
covalentes moleculares pueden ser sólidos, líquidos o gaseosos a temperatura
ambiente. Por ejemplo el azúcar es un sólido, el agua es un líquido y el
dióxido de carbono es un gas.
8.
La formación de enlaces covalentes también
puede ocurrir entre átomos de elementos del
tipo.
9.
Son ejemplos el
(H2), el oxígeno (O2), el flúor (F2) y el
cloro (Cl2), entre otros.
10. Otros
elementos como el carbono C, pueden formar múltiples enlaces covalentes entre
sus átomos; cuando esto sucede se pueden formar
covalentes de átomos.
EJERCICIO:
El dióxido de carbono
es un compuesto covalente molecular. Identifica:
1. Qué
no metales lo forman
2. Cuantos
átomos de oxígeno se requieren para completar el octeto de Lewis.
3. Cuantos
electrones comparte el carbono con cada oxígeno.
4. Escribe
la fórmula química del dióxido de carbono.
5. Dibuja
la molécula del dióxido de carbono.
APUNTE:
En los
compuestos covalentes, se escribe primero el no metal que se ubica al lado
izquierdo de la tabla periódica y después el no metal que se ubica al lado
derecho; y se nombran mencionando al segundo no metal con la terminación uro y
luego el nombre del primer no metal.
Nombre del
compuesto: prefijo raiz(no metal más electronegativo) uro de prefijo no metal
menos electronegativo.
S3N4
tetranitruro de triazufre
PCl5
pentacloruro de fosforo
EJERCICIO: Completa la
tabla.
Formula
|
Nombre
|
Primer
No Metal
|
Electrones
que comparte
|
Segundo
No metal
|
Electrones
que comparte
|
Modelo
de Lewis
|
Modelo
cinético de partículas
|
P2S3
|
Trisulfuro
de difósforo
|
||||||
CH4
|
Tetrahidruro
de carbono
|
||||||
NH3
|
Trihidruro
de nitrógeno
|
||||||
CCl4
|
Tetracloruro
de carbono
|
||||||
CBr4
|
Tetrabromuro
de carbono
|
||||||
CS2
|
Disulfuro
de carbono
|
||||||
SiBr4
|
Tetrabromuro
de silicio
|
||||||
NF3
|
Trifluoruro
de nitrógeno
|
||||||
BrCl
|
Cloruro
de bromo
|
||||||
SeI2
|
Diyoduro
de selenio
|
||||||
O2
|
|||||||
Cl2
|
|||||||
H2
|
|||||||
F2
|
|||||||
N2
|
ACTIVIDAD 4: ENLACE
METALICO.
LEE EL TEXTO.
ENLACE METALICO
En una sustancia metálica, como el
cobre o el oro, los millones de átomos que la constituyen pierden y comparten
simultáneamente sus electrones de valencia. Lo que sucede es que los electrones
de valencia se desplazan libremente de un átomo a otro a través de la red de
átomos en el metal. Cada átomo del metal adquiere una carga positiva porque
pierde sus electrones de valencia, pero todas estas cargas negativas se
mantienen circulando entre los átomos y forman lo que se conoce como un “mar
de electrones”. La fuerza entre el mar de electrones y los iones con carga
positiva se denomina enlace metálico.
Como los electrones de valencia en
un metal se mueven libremente de un lugar a otro, este tipo de sustancias son
buenas conductoras de la electricidad. El enlace metálico también mantiene a
los átomos unidos en mezclas de varios metales o aleaciones, como el bronce
(mezcla de cobre con estaño) y el latón (mezcla de cobre con zinc).
MOLECULA DE ORO
|
CUESTIONARIO:
1. ¿Qué fenómeno ocurre con los electrones de valencia de
los átomos de los metales?
2. ¿Por qué adquieren carga positiva los átomos de los
metales?
3. ¿Qué es un “mar de electrones”?
4. ¿Qué es el enlace metálico?
5. ¿Por qué son buenos conductores de electricidad los
metales?
6. ¿Qué tipo de enlace se presenta entre las aleaciones de
metales?
7. ¿Qué metales forman el bronce?
8. ¿Qué metales forman el latón?
EJERCICIO:
El
cobre es un elemento que presenta enlace metálico. Identifica:
1. Cuantos electrones de valencia tiene.
2. Cuál es el símbolo químico del cobre.
3. Cuantos electrones puede compartir con los otros átomos
de cobre.
4. Dibuja la molécula del cobre.
5. Menciona otros metales que se ubiquen en los grupos 8 al
12.
ANALISIS DE LECTURA
EL
AGUA
El agua
es el principal e imprescindible componente del cuerpo humano. El ser humano
no puede estar sin beberla más de cinco o seis días sin poner en peligro su
vida. El cuerpo humano tiene un 75 % de agua al nacer y cerca del 60 % en la
edad adulta. Aproximadamente el 60 % de este agua se encuentra en el interior
de las células (agua intracelular). El resto (agua extracelular) es la que
circula en la sangre y baña los tejidos.
En las reacciones
de combustión de los nutrientes que tiene lugar en el interior de las células
para obtener energía se producen pequeñas cantidades de agua. Esta formación
de agua es mayor al oxidar las grasas (1 gramo de agua
por cada gramo de grasa), que los almidones (0,6 gramos por gramo de almidón). El agua producida en
la respiración celular se llama agua metabólica, y es fundamental para los
animales adaptados a condiciones desérticas. Si los camellos pueden aguantar
meses sin beber es porque utilizan el agua producida al quemar la grasa
acumulada en sus jorobas. En los seres humanos, la producción de agua
metabólica con una dieta normal no pasa de los 0.3 litros al día.
Porque
el agua es importante en muchas funciones del cuerpo, tener suficiente agua
en nuestro organismo es un factor clave para tener salud y mantenerse
saludable.
El agua es imprescindible para el
organismo. Por ello, las pérdidas que se producen por la orina, las heces, el
sudor y a través de los pulmones o de la piel, han de recuperarse mediante el
agua que bebemos y gracias a aquella contenida en bebidas y alimentos.
Es muy importante consumir una cantidad
suficiente de agua cada día para el correcto funcionamiento de los procesos
de asimilación y, sobre todo, para los de eliminación de residuos del
metabolismo celular. Necesitamos unos tres litros de agua al día como mínimo,
de los que la mitad aproximadamente los obtenemos de los alimentos y la otra
mitad debemos conseguirlos bebiendo.
Por supuesto en las siguientes
situaciones, esta cantidad debe incrementarse:
·
Al practicar ejercicio físico.
·
Cuando la temperatura ambiente es elevada.
·
Cuando tenemos fiebre.
·
Cuando tenemos diarrea.
En
situaciones normales nunca existe el peligro de tomar más agua de la cuenta
ya que la ingesta excesiva de agua no se acumula, sino que se elimina.
Si consumimos agua en grandes cantidades
durante o después de las comidas, disminuimos el grado de acidez en el
estómago al diluir los jugos gástricos. Esto puede provocar que los enzimas
que requieren un determinado grado de acidez para actuar queden inactivos y
la digestión se ralentice. Los enzimas que no dejan de
actuar por el descenso de la acidez, pierden eficacia al quedar diluidos. Si
las bebidas que tomamos con las comidas están frías, la temperatura del
estómago disminuye y la digestión se ralentiza aún más.
Como norma general, debemos beber en los intervalos
entre comidas, entre dos horas después de comer y media hora antes de la
siguiente comida. Está especialmente recomendado beber uno o dos vasos de
agua nada al levantarse. Así conseguimos una mejor hidratación y activamos
los mecanismos de limpieza del organismo.
|
CUESTIONARIO:
1.
¿Qué cambio se presenta en el porcentaje de
agua que tiene el ser humano al aumentar su edad?
2.
¿Qué cantidad de agua nos aporta el
metabolismo de los alimentos?
3.
¿Por qué es importante para el cuerpo humano
consumir agua?
4.
¿Qué cantidad de agua requerimos al día?
5.
¿Qué problemas podemos tener por tomar agua
en exceso durante o después de las comidas?
6.
¿Cómo se llama el elemento que pierde
electrones?
7.
¿Qué tipo de enlace se presenta en el cloruro
de sodio?
8.
Realiza el modelo de Lewis del cloruro de
sodio.
9.
Representa el modelo de Lewis del dióxido de
carbono.
10.
¿Qué tipo de enlace se presenta en el
tetracloruro de carbono?






No hay comentarios.:
Publicar un comentario